„Manufacturing waiver” – słabsze SPC po wprowadzeniu przywileju produkcyjnego
1 lipca 2019 r. w życie weszło rozporządzenie Parlamentu Europejskiego i Rady (UE) 2019/933 z 20 maja 2019 r. zmieniające rozporządzenie (WE) nr 469/2009 dotyczące dodatkowego świadectwa ochronnego dla produktów leczniczych. Rozporządzenie wprowadziło tzw. przywilej produkcyjny wyłączający niektóre działania producentów leków mających siedzibę w Unii Europejskiej spod zakresu ochrony przyznanej na podstawie dodatkowego świadectwa ochronnego.
Dodatkowe prawo ochronne
Celem dodatkowego świadectwa ochronnego (dalej z ang. SPC – Supplementary Protection Certificate) jest przedłużenie ochrony patentowej na lek. Dodatkowy okres wyłączności (maksymalnie 5 lat) ma rekompensować uprawnionemu skrócenie możliwości rzeczywistego korzystania z wyłączności rynkowej, jaką daje patent. Uprawniony bowiem po zgłoszeniu wynalazku, a zanim wprowadzi lek na rynek, często przeprowadzić musi jeszcze żmudne i kosztowne badania, mające zweryfikować skuteczność leku i pozwolić na dopełnienie procedur dopuszczenia leku do obrotu.
Ochrona przyznana przez SPC mieści się w zakresie ochrony przyznanej patentem podstawowym, ale ogranicza ją do produktu – leku objętego dopuszczeniem do obrotu. Uprawniony na podstawie SPC może sprzeciwić się między innymi wytwarzaniu, oferowaniu, wprowadzaniu do obrotu lub importowaniu dla tych celów produktu będącego przedmiotem ochrony.
SPC po nowemu
Omawiana zmiana wprowadza wyłom w zakresie przyznanej uprawnionemu ochrony. Tak zwany przywilej produkcyjny (ang. manufacturing waiver) pozwala producentowi leku w określonych okolicznościach na wytwarzanie, magazynowanie i eksport leków pomimo obowiązywania SPC. Dotyczy to dwóch sytuacji:
- wytwarzania leku na eksport na rynki poza UE, na których brak ochrony patentowej dla danego leku,
- wytwarzania leku w celu przygotowania jego zapasu (stockpiling), tak aby możliwe było zaoferowanie leku generycznego / biopodobnego na terenie UE niezwłocznie, wręcz następnego dnia po ustaniu ochrony wynikającej z SPC; w tym przypadku wyjątek pozwala na wytwarzanie leku tylko w ciągu ostatnich sześciu miesięcy przed wygaśnięciem SPC.
Ochrona uprawnionych
Szereg postanowień rozporządzenia ma służyć zapewnieniu przejrzystości działań podejmowanych w ramach ww. przywileju przez producenta leku. Chodzi o to aby nie pozbawiać uprawnionego z SPC skutecznego egzekwowania ochrony, jeśli działania producenta wyjdą poza zakres objęty przywilejem.
Producenci leków zobowiązani są powiadomić uprawnionego z SPC oraz urząd patentowy państwa członkowskiego właściwego ze względu na miejsce wytwarzania leku o zamiarze rozpoczęcia produkcji. Powiadomienie to powinno mieć miejsce na 3 miesiące przed rozpoczęciem produkcji lub podjęcia innej czynności powiązanej z rozpoczęciem działania, objętego przywilejem, która to czynność – gdyby nie przywilej – stanowiłaby naruszenie SPC. W tym celu producent powinien skorzystać z dołączonego do rozporządzenia formularza, w którym wskazać należy między innymi producenta, cel i miejsce wytwarzania oraz numer SPC, którego powiadomienie dotyczy. Urząd patentowy jest obowiązany do jak najszybszego opublikowania zgłoszonych informacji wraz z datą, z jaką otrzymał te informacje.
W przypadku leku wytwarzanego w celu wywozu do państw trzecich producent ma również obowiązek umieszczenia na zewnętrznym opakowaniu (np. tekturowym kartoniku), a jeżeli to możliwe także na opakowaniu bezpośrednim (np. blistrze czy słoiczku), określonego w rozporządzeniu logo, które wskazuje na przeznaczenie produktu na eksport do krajów spoza UE.

Rozporządzenie wprowadza też wymóg zapewnienia przez producenta za pomocą odpowiednich i udokumentowanych środków, aby osoby, z którymi pozostaje w stosunkach umownych i które wykonują działania objęte przywilejem, były w pełni poinformowane i świadome, że działania te są podejmowane w ramach wyjątku przewidzianego w rozporządzeniu oraz że wprowadzenie do obrotu, przywóz lub ponowny przywóz leku przeznaczonego na eksport do państw spoza UE, lub wprowadzenie do obrotu leku wytwarzanego w celu jego wprowadzenia na rynek UE po wygaśnięciu SPC, może stanowić naruszenie prawa.
Wątpliwości
Rozporządzenie jest efektem wielomiesięcznych prac, które miały doprowadzić do kompromisowego rozwiązania mającego pogodzić interesy producentów leków innowacyjnych oraz producentów leków generycznych i biopodobnych. Czyniąc wyłom w zakresie ochrony praw własności przemysłowej, ustawodawca unijny przewidział środki mające zabezpieczać właścicieli praw przed nadużyciami. Czy przyjęte rozwiązanie sprosta temu zadaniu, pokaże czas, jednak już w trakcie prac nad rozporządzeniem zarzucano przyjętej regulacji szereg niejasności, które nie zostały usunięte z tekstu rozporządzenia.
Po pierwsze, wskazuje się na zbyt ogólne określenie informacji, które przekazywać ma producent uprawnionemu i właściwemu urzędowi patentowemu. Powiadomienie obejmuje jedynie informację o producencie, co może skutkować pominięciem podmiotu, który rzeczywiście wytwarza dany lek lub go magazynuje na zlecenie „producenta”. Brak takiej informacji może utrudnić weryfikację, czy działania podmiotów pozostają w zgodzie z przywilejem.
Po drugie, niektóre działania objęte przywilejem nie zostały zdefiniowane w rozporządzeniu np.: wszelkie działania powiązane, które są ściśle niezbędne do wytwarzania (…), lub ściśle niezbędne do samego magazynowania. Może więc budzić wątpliwości, co mieści się w granicach wyznaczonych przez przywilej, a co stanowi już naruszenie SPC.
Po trzecie, wątpliwości budzi wymóg, aby osoby, z którymi producent pozostaje w stosunkach umownych i które wykonują działania objęte wyjątkiem, były przez niego w pełni poinformowane i świadome, że podejmują działania w ramach tego wyjątku. Nie przewidziano jednak, jak postulowano, aby producent leku miał obowiązek monitorowania działań tych podmiotów, albo przejmował odpowiedzialność za ich działania w przypadku wykroczenia poza zakres przywileju.
Po czwarte, podkreślono, że logo mające wskazywać, iż produkt jest przeznaczony na eksport do krajów spoza UE, musi być umieszczone na opakowaniu zewnętrznym, a na wewnętrznym tylko wtedy, jeżeli jest to możliwe. Producenci leków mogą się zasłaniać tym ograniczeniem, umieszczając logo jedynie na opakowaniu zewnętrznym, by móc następnie łatwo przepakować produkt wytarzany na eksport w celu zaoferowania go na rynku unijnym. Może to prowadzić do prób omijania ograniczenia, które pozwala powoływać się na przywilej produkcyjny w odniesieniu do przygotowania zapasów leku na potrzeby rynku UE jedynie w okresie 6 miesięcy poprzedzających wygaśnięcie SPC.
Okres przejściowy
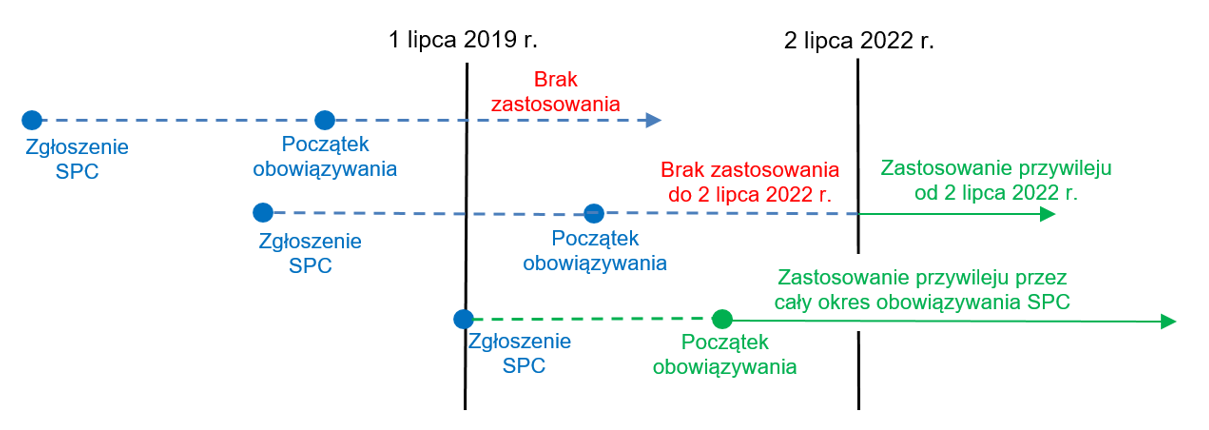
Skutki rozporządzenia, przynajmniej na początku jego obowiązywania, zostaną jednak złagodzone wprowadzonymi włączeniami i okresami przejściowymi. Bez ograniczeń przywilej produkcyjny będzie miał zastosowanie jedynie w odniesieniu do SPC, o które wniesiono 1 lipca 2019 r. lub po tym dniu. Przywilej produkcyjny nie ma natomiast zastosowania do SPC, którego skutki (początek obowiązywania SPC) powstały przed dniem wejścia w życie niniejszego rozporządzenia.
Z uwagi jednak na to, że SPC zaczyna obowiązywać dopiero po upływie okresu obowiązywania patentu podstawowego (często długo po dacie złożenia wniosku o przyznanie SPC), przyjęto, że przywilej produkcyjny dotyczyć będzie również SPC, o wydanie których złożono wniosek przed dniem wejścia w życie rozporządzenia, lecz których obowiązywanie rozpoczęło w tym dniu lub później. W takiej sytuacji rozporządzenie przewiduje jednak okres przejściowy – skutki przywileju w odniesieniu do takiego SPC będą miały zastosowanie dopiero po 2 lipca 2022 r.
Skutki
Jak wskazano w preambule, celem rozporządzenia jest wspieranie konkurencyjności producentów leków generycznych i biopodobnych mających siedzibę w Unii Europejskiej. Ma to również umożliwić szybkie wprowadzanie na rynek unijny leków generycznych i biopodobnych, co ma zwiększyć konkurencję, obniżyć cenę i poprawić dostęp do przystępnych cenowo leków. Jak wskazuje się w opracowaniach przygotowywanych na etapie prac legislacyjnych, zmiany regulacji SPC mogą przynieść olbrzymie korzyści dla europejskiego rynku farmaceutycznego. Wskazuje się między innymi na 9,5 miliarda EUR dodatkowej sprzedaży netto i 25 tysięcy dodatkowych miejsc pracy, w tym 254,3 miliona EUR w sprzedaży netto i 2 tysiące nowych miejsc pracy związanych z wytwarzaniem substancji aktywnych. Podkreśla się również spodziewane pozytywne skutki dla całego systemu ochrony zdrowia. Przewiduje się w związku z tym znaczne oszczędności dla europejskiego systemu ochrony zdrowia (3,1 miliarda EUR). Oszczędności te przynieść ma między innymi szybsze wejście na rynki unijne leków generycznych i biopodobnych pochodzących od producentów unijnych.
Norbert Walasek, adwokat, praktyka własności intelektualnej kancelarii Wardyński i Wspólnicy
